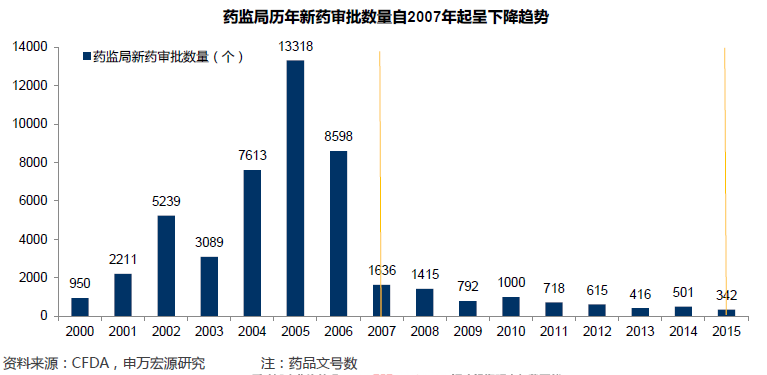
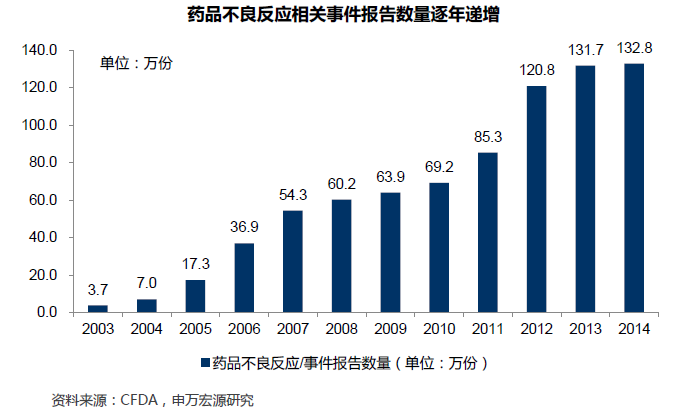
流通藥品質量不一,提升標準勢在必行。中國藥品審評審批法規幾經修訂,目前流通中藥品批文估計超過18萬個,依據地方標準批準后經“地標轉國標”的品種、鄭筱萸主政國家局期間批準品種、2007年藥審標準收緊后獲批品種同時存在,流通中藥品標準不一現象客觀存在。部分產品療效存疑、存在安全隱患;不少產品獲得幾乎永久“獨家”資質;安全無效藥品大行其道,侵蝕寶貴醫保資源;外企原研藥享受價格超國民待遇,占據二三級醫院主要市場份額;企業創新激勵機制扭曲,低水平重復建設現象十分嚴重。中國政府致力于推動藥品審評審批領域全面變革,提升藥品質量,促進行業優勝劣汰。
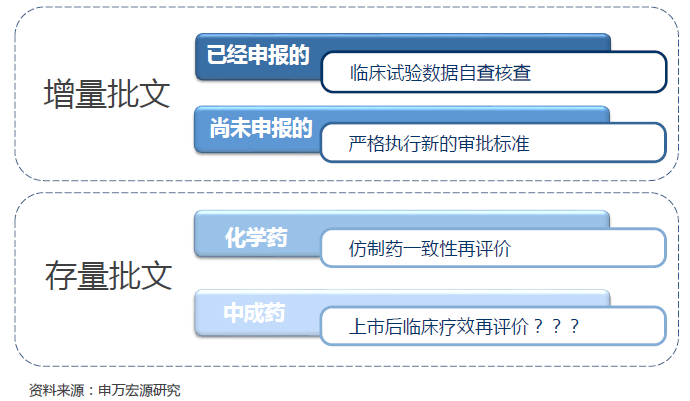
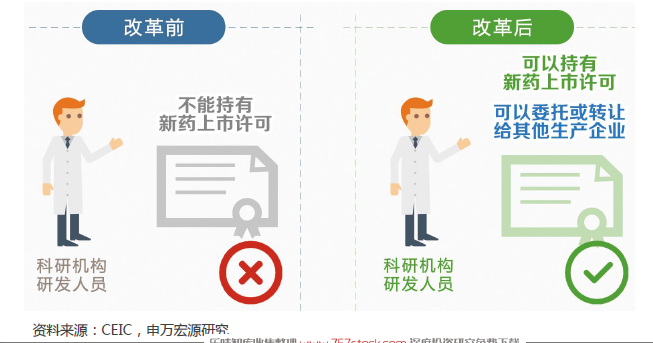
全面提升審評標準,確保新品質量一流。新化學藥注冊分類標準出臺,針對不同分類化學藥審評細則將很快出臺,預計新標準將更為嚴厲,從而確保每個新品種都將擁有一流質量。針對目前大量在報產品種,2015年8月國家局發動史上最嚴臨床數據自查核查,截止目前,約83.4%的品種已經撤回或不批準,核查之嚴可見一斑。為將有限審評資源向具備突出臨床價值的新品種傾斜,藥監局大力推出優先審評審批政策,臨床價值成為能否獲得優先審評資格的核心判定標準。為解決醫藥行業生產能力過剩,生產設施低水平重復建設,促進新藥創制投入和水平,上市許可持有人制度獲得試點,專業CMO企業將迎來黃金發展機遇。
仿藥一致性再評價,提升流通藥品質量。借鑒美國、日本等國仿制藥一致性再評價經驗,國務院2013年首次提出仿制藥質量一致性再評價任務,經過三年時間逐步加深認知和政策調整,2016年3月國務院正式印發關于開展仿制藥質量和療效一致性評價的意見。全部化學藥品均需通過仿制藥一致性再評價,2012版基藥目錄中口服藥品種要求2018年底前完成,其他品種分期分批逐步推進。通過一致性再評價品種將在定價、醫保報銷、招標、醫院處方等環節獲得更大優勢,企業核心品種有充分激勵盡早完成一致性再評價。我國有約11萬個化藥批文,按500萬/個費用投入測算,假設十年完成全部再評價工作,全行業面臨5500億資金投入,平均每年投入約550億,占我國醫藥行業收入約5%,當前行業平均研發投入僅占收入約2%;臨床基地資源十分有限,在研創新藥、在研仿制藥和一致性再評價品種同時競爭有限臨床基地資源;我國采用生物等效性試驗作為一致性評價標準,對照品獲取存在諸多障礙。我們認為,我國制藥行業門檻將大幅提高,行業優勝劣汰是必然趨勢,強者有望恒強。